修回日期: 2018-12-10
接受日期: 2018-12-31
在线出版日期: 2019-01-28
分析黄芪建中汤加味对糖尿病胃轻瘫(diabetic gastroparesis, DGP)大鼠的疗效及其对胃窦干细胞因子(stem cell factor, SCF)-Kit信号途径的影响.
选取SPF级Wistar雄性大鼠75只, 随机数字表法降低大鼠分成5组, 模型组、正常组、阳性对照组、黄芪建中汤加味低剂量组及黄芪建中汤加味高剂量组, 各15只, 除正常组外, 其他各组大鼠制备DGP模型, 造模后阳性对照组大鼠灌胃0.78 g/mL的吗丁啉混悬液, 黄芪建中汤加味低剂量组、黄芪建中汤加味高剂量组分别灌胃0.78 g/mL、3.12 g/mL的黄芪建中汤加味药液, 正常组和模型组灌胃生理盐水, 各组大鼠给药体积为10 mL/kg, 持续灌胃6 wk; 观察各组大鼠一般状况、体重、胃拍空率、血清可溶型SCF(soluble SCF, sSCF)、胃泌素(gastrin, GAS)、胃动素(motilin, MLT)含量及胃窦组织内Cajal间质细胞(interstitial cells of Cajal, ICC)含量、c-kit、膜结合型SCF(membrane-bound SCF, mSCF)蛋白表达量.
和正常组相比, 模型组大鼠血糖、GAS及MLT含量上升, 可溶型SCF(soluble SCF, sSCF)含量、胃排空率下降; 和模型组相比, 阳性对照组、黄芪建中汤加味低剂量组及黄芪建中汤加味高剂量组大鼠血糖、GAS及MLT含量下降, sSCF含量、胃排空率上升, 差异有统计学意义(P<0.05); 和正常组相比, 模型组大鼠胃窦组织内c-kit、mSCF蛋白表达下降; 和模型组相比, 阳性对照组、黄芪建中汤加味低剂量组及黄芪建中汤加味高剂量组大鼠c-kit、mSCF蛋白表达上升, 差异有统计学意义(P<0.05); 和阳性对照组相比, 黄芪建中汤加味低剂量组及黄芪建中汤加味高剂量组大鼠c-kit、mSCF蛋白表达上升, 但差异无统计学意义(P>0.05).
黄芪建中汤加味经过提升mSCF蛋白表达, 上调SCF-Kit信号途径, 使DGP大鼠胃窦组织内ICC含量增大, 改善其胃起搏功能, 胃动力增强.
核心提要: 糖尿病胃轻瘫(diabetic gastroparesis, DGP)为临床多见疾病, 是糖尿病所造成慢性并发症, 黄芪建中汤加味经过提升膜结合型干细胞因子(stem cell factor, SCF)蛋白表达, 上调SCF-Kit信号途径, 使DGP大鼠胃窦组织内Cajal间质细胞含量增大, 改善其胃起搏功能, 胃动力增强.
引文著录: 孔梦梦, 黄平, 贾彩华. 黄芪建中汤加味对糖尿病胃轻瘫大鼠的疗效及其对胃窦SCF-Kit信号途径的影响研究. 世界华人消化杂志 2019; 27(2): 87-93
Revised: December 10, 2018
Accepted: December 31, 2018
Published online: January 28, 2019
To analyze the therapeutic effect of Huangqi Jianzhong decoction on diabetic gastroparesis (DGP) in rats and its impact on the stem cell factor (SCF)-Kit signaling pathway in the gastric antrum.
Seventy-five male Wistar rats of SPF grade were randomly divided into five groups: model group, normal group, positive control group, low-dose Huangqi Jianzhong decoction group, and high-dose Huangqi Jianzhong decoction group (15 rats in each group). Except the normal group, DGP was induced in other groups. After DGP was induced, the rats in the positive control group were intra-gastrically administered with 0.78 g/mL of morphine suspension, and the two Huangqi Jianzhong decoction groups were intra-gastrically administered with 0.78 g/mL and 3.12 g/mL of Huangqi Jianzhong decoction. The normal group and the model group were given normal saline. The dose of each group was 10 mL/kg. After continuous administration for 6 wk, the general condition, body weight, gastric emptying rate, serum soluble SCF (sSCF), gastrin (GAS), motilin (MLT), and interstitial cells of Cajal (ICC) in the gastric antrum were observed. C-kit and membrane-bound SCF (mSCF) protein expression was detected.
Compared with the normal group, the blood glucose, GAS, and MLT levels in the model group increased, and the sSCF content and gastric emptying rate decreased. Compared with the model group, positive control group, and low dose Huangqi Jianzhong decoction group, the contents of blood glucose, GAS, and MLT significantly decreased, and the sSCF content and gastric emptying rate significantly increased in the high-dose group (P < 0.05). Compared with the normal group, the expression of c-kit and mSCF proteins in the gastric antrum decreased in the model group. Compared with the model group, the expression of c-Kit and mSCF proteins in the positive control group, low-dose and high-dose Huangqi Jianzhong decoction groups significantly increased (P < 0.05). Compared with the positive control group, the expression of c-Kit and mSCF proteins in the low-dose and high-dose Huangqi Jianzhong decoction groups increased, but the difference was not statistically significant (P > 0.05).
Huangqi Jianzhong decoction enhances the expression of mSCF protein and up-regulates the SCF-Kit signaling pathway, which increases the number of ICC in the gastric antrum of DGP rats, improves gastric pacing function, and enhances gastric motility.
- Citation: Kong MM, Kong MM, Huang P, Jia CH. Therapeutic effect of Huangqi Jianzhong decoction on diabetic gastroparesis in rats: Impact on SCF-Kit signaling pathway in the gastric antrum. Shijie Huaren Xiaohua Zazhi 2019; 27(2): 87-93
- URL: https://www.wjgnet.com/1009-3079/full/v27/i2/87.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i2.87
糖尿病胃轻瘫(diabetic gastroparesis, DGP)为临床多见疾病, 是糖尿病(diabetes mellitus, DM)所造成慢性并发症, 临床患者胃动力及胃张力下降、排空延迟、节律紊乱, 临床症状多表征为呕吐、腹胀、恶心、嗳气及早饱等[1]. 当前关于DGP发病因素尚未完全明确, 可能和感染幽门螺旋杆菌、神经病变、胃肠平滑肌及微血管病变、胃肠道激素改变、高血糖等有联系[2]. 相关研究显示, 在DGP发病中Cajal间质细胞(interstitial cells of Cajal, ICC)病变有重要影响, 它为机体内胃肠道运动起搏细胞, 对胃肠道的自主节律运动有调控影响, 同时对传递神经信号与传播消化道电活动也很重要[3]. ICC的特异性标志物酪氨酸激酶受体(tyrosine kinase receptor, Kit)天然配体是干细胞因子(stem cell factor, SCF), 上述两者可产生SCF-Kit信号路径, 该路径对ICC发育及保持ICC功能与形态非常重要. 当前, 西医对DGP治疗为胃电起搏、促进胃动力及控制血糖等, 患者疗效不太理想且副作用较大, 而中医在辩证治疗基础上, 对DGP患者预防复发和缓解症状方面疗效显著[4]. 因此, 本研究经过分析黄芪建中汤加味对DGP大鼠的疗效及其对胃窦SCF-Kit信号途径的影响, 为临床患者治疗提供一些思路.
选取SPF级Wistar雄性大鼠75只, 六周龄, 购自北京维通利华实验动物公司, 许可证号: SCXK(京): 2018-28, 体重在180-200 g间, 平均体重191.24 g±5.27 g. 常规饲养一周后开始实验, 大鼠分笼饲养, 每个笼内5只, 室温维持在22 ℃-26 ℃, 相对湿度在55%-65%间, 昼夜循环, 保持12 h光照, 大鼠灌胃、添加饲料及换水等都有专人进行.
药物: 黄芪建中汤加味(炙甘草15 g, 黄芪60 g, 炒麦芽15 g, 桂枝15 g, 茯苓20 g, 白芍15 g, 党参30 g, 干姜15 g, 白术15 g, 枳壳20 g及大枣30 g), 加入清水煎熬取汁; 吗丁啉(西安杨森制药公司, 规格: 10 mg/片, 批号: H22133067). 试剂: 可溶型SCF(soluble SCF, sSCF)试剂盒(购自美国RD公司), 胃泌素(gastrin, GAS)、胃动素(motilin, MLT)购自昆明腾昆科技公司, 链脲佐菌素(STZ)(购自美国Sigma公司), 兔抗大鼠SCF多克隆抗体(一抗)及兔抗c-kit多克隆抗体(一抗)(购自武汉博士德生物公司). 仪器: 病理组织漂烘仪(型号: PHY-Ⅲ, 由常州中威电子仪器厂生产), 转轮式切片机(型号: 莱卡-2016, 由德国莱卡公司生产), 全波长扫描型酶标仪(型号: Mutiskan Go型, 由美国赛默飞世尔公司生产), 全自动封闭式组织脱水机(型号: TSJ-Ⅱ, 由常州中威电子仪器厂生产), 包埋机(型号: BMJ-Ⅲ, 由常州中威电子仪器厂生产), 电泳仪(型号: DYY-2C, 由北京六一仪器厂生产), BH-2生物显微镜(由日本OLYMPLUS公司生产), 天能GIS凝胶图像处理系统(由上海天能科技公司生产).
随机数字表法降低大鼠分成5组, 模型组、正常组、阳性对照组、黄芪建中汤加味低剂量组及黄芪建中汤加味高剂量组, 各15只. STZ内加入0.1 mmol/L的柠檬酸钠缓冲液, 制备为含量1.0%溶液, 除正常组外, 其他各组大鼠均在腹腔内一次性注入剂量为45 mg/kg溶液, 注射后72 h取大鼠尾静脉血液行空腹血糖检测, 若其血糖含量≥16.8 mmol/L则说明成功造模, 各组大鼠均造模成功.
造模后阳性对照组大鼠灌胃0.78 g/mL的吗丁啉混悬液, 黄芪建中汤加味低剂量组、黄芪建中汤加味高剂量组分别灌胃0.78 g/mL(相当临床成人等效剂量)、3.12 g/mL(相关临床成人量4倍)的黄芪建中汤加味药液, 正常组和模型组灌胃生理盐水, 各组大鼠给药体积为10 mL/kg, 持续灌胃6 wk.
1.2.1 大鼠一般活动状况及体重改变情况: 观察给药期间大鼠饮食、活动及毛发情况, 记录各组大鼠在给药1、3、6 wk时体重状况.
1.2.2 各组大鼠血清指标及胃排空率状况: 胃排空率: 末次给药后大鼠禁食12 h, 灌胃2 mL的5%酚红, 30 min后大鼠麻醉剖腹, 将幽门与贲门结扎, 全胃取出放置在培养皿内, 沿着胃大弯将胃体剪开, 胃内容物充分清洗, 定容10 mL, 在加入5 mL剂量为1 mol/L的NaOH, 混匀, 室温内放置1 h后选取上清液5 mL, 加入0.5 mL的20%三氯乙酸去蛋白, 离心后取上清液, 检测吸光度A值, 胃拍空率 = (1-实测酚红残留量/酚红灌胃量)×100%.
末次给药后, 大鼠腹腔注射剂量为0.8 mL/100 g的2.4%水合氯醛麻醉, 断颈处死, 取腹主动脉血液6 mL, 血糖仪检测其血糖状况, ELISA法检测血清sSCF、GAS、MLT含量, 标准品稀释后加入至酶标板标准品孔内, 样品加入到样品孔内, 每个孔内10 mL, 胶纸将反应孔封住, 37 ℃下孵育2 h, 洗板五次, 在加入10 mL生物素化抗体工作液, 37 ℃下孵育1 h, 洗板五次, 加入10 mL酶结合物工作液, 37 ℃下避光孵育30 min, 洗板五次, 每孔加入10 mL显色液, 37 ℃下避光孵育20 min, 最后加入终止液, 混匀后检测OD450数值.
1.2.3 胃窦ICC数量状况: 各组大鼠胃排空率检测完后, 取距离幽门0.5 cm位置的胃窦组织, 免疫检测大鼠胃窦组织内ICC数量状况, 石蜡切片脱蜡后将内源性过氧化物酶灭活, 热修复暴露抗原位点, 置入孵育盒内, 使用PBS溶液冲洗三次, 每次3 min, 加入山羊血清, 孵育10 min, 在加入一抗兔多克隆抗体, 在4 ℃下过夜. PBS溶液冲洗三次, 每次5 min, 滴入二抗在室温下孵育10 min, 使用PBS溶液冲洗三次, 每次3 min, 在滴入辣根酶标记链酶卵白素, 采用DAB显色, 中性树胶封片. 棕黄色为染色阳性, 使用Image-Pro Plus6.0图片分析检测检测图像光密度.
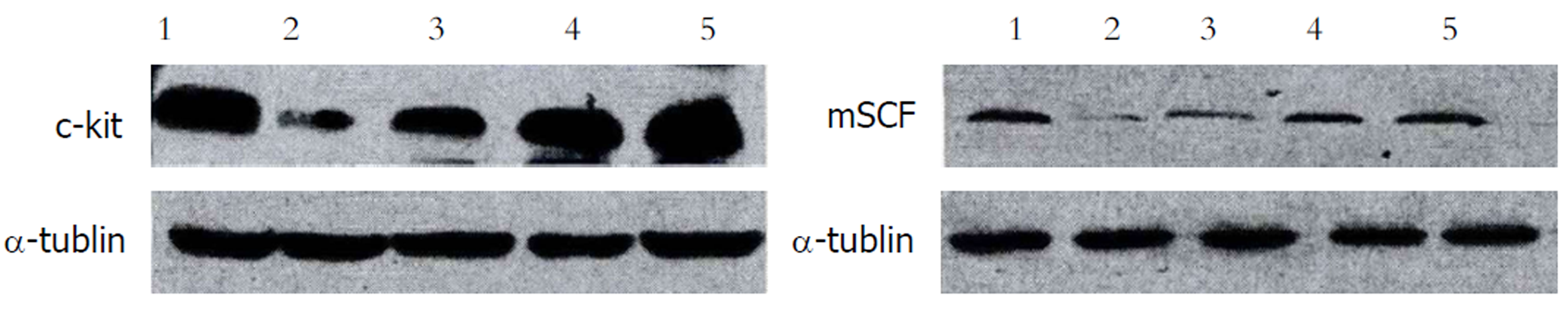
1.2.4 Western-blot检测大鼠胃窦组织内c-kit、膜结合型SCF蛋白表达量: 选取大鼠胃窦组织研磨, 经过组织裂解后上样电泳, 起始电压80 V, 溴酚蓝染料前缘进入到分离胶上缘后电压提升到100 V, 溴酚蓝泳出分离胶下缘后电泳结束. 半干电转移仪于PVDF膜内行蛋白质电转移, 恒流为30 mA, 连续90 min. PVDF膜取出后采用5%TBST脱脂奶粉封闭, 震荡60 min. 结束封闭后采用TNS-T漂洗液洗膜10 min, 3次, 把膜转移到杂交袋内, 加入适量漂洗液稀释抗体, 封口后在4 ℃下孵育过夜; TBST漂洗液洗膜10 min, 3次, 在加入漂洗液稀释的辣根过氧化物酶标记二抗, 震荡60 min. PVDF膜放置在ECL显色液内震荡温育5 min, 暗室下曝光、显影及定影. 清水冲洗以后, 晾干扫描, IPP软件对扫描图像目的条带行灰度分析.
统计学处理 采用SPSS 19.0统计软件进行数据分析, 计量资料mean±SD表示, t检验, 计数资料χ²检验, P<0.05差异有统计学意义.
正常组大鼠饮水、进食正常, 活动敏捷, 毛色光滑, 粪便为棕褐色, 尿量正常; 模型组大鼠表征为多尿、多食及多饮, 活动迟缓, 毛色干枯无光泽, 大便不成形, 精神倦怠; 阳性对照组、黄芪建中汤加味低剂量组及黄芪建中汤加味高剂量组大鼠饮食量较模型组减少, 趋于正常, 毛发有光泽, 活跃喜动, 大便成形.
和正常组相比, 给药后1、3、6 wk模型组大鼠体重降低; 和模型组相比, 给药后1、3、6 wk阳性对照组、黄芪建中汤加味低剂量组及黄芪建中汤加味高剂量组大鼠体重上升, 差异均有统计学意义(P<0.05); 和阳性对照组相比, 给药后1、3、6 wk黄芪建中汤加味低剂量组及黄芪建中汤加味高剂量组大鼠体重上升, 但差异无统计学意义(P>0.05), 详见表1.
和正常组相比, 模型组大鼠血糖、GAS及MLT含量上升, sSCF含量、胃排空率下降; 和模型组相比, 阳性对照组、黄芪建中汤加味低剂量组及黄芪建中汤加味高剂量组大鼠血糖、GAS及MLT含量下降, sSCF含量、胃排空率上升, 差异有统计学意义(P<0.05), 详见表2.
| 分组 | 血糖(mmol/L) | sSCF(pg/mL) | GAS(pg/mL) | MLT(pg/mL) | 胃排空率(%) |
| 正常组 | 8.73 ± 2.64 | 170.02 ± 6.37 | 232.21 ± 9.83 | 141.35 ± 12.76 | 52.79 ± 3.14 |
| 模型组 | 25.26 ± 2.73a | 134.35 ± 6.29a | 313.07 ± 9.81a | 201.69 ± 12.08a | 41.01 ± 3.26a |
| 阳性对照组 | 19.83 ± 2.59c | 155.79 ± 6.28c | 261.20 ± 9.53c | 157.49 ± 12.26c | 47.83 ± 3.15c |
| 黄芪建中汤加味低剂量组 | 19.14 ± 2.45c | 153.27 ± 6.57c | 260.07 ± 9.42c | 155.79 ± 12.04c | 48.21 ± 3.55c |
| 黄芪建中汤加味高剂量组 | 18.80 ± 2.31c | 151.94 ± 6.42c | 258.73 ± 9.34c | 154.07 ± 12.13c | 48.76 ± 3.39c |
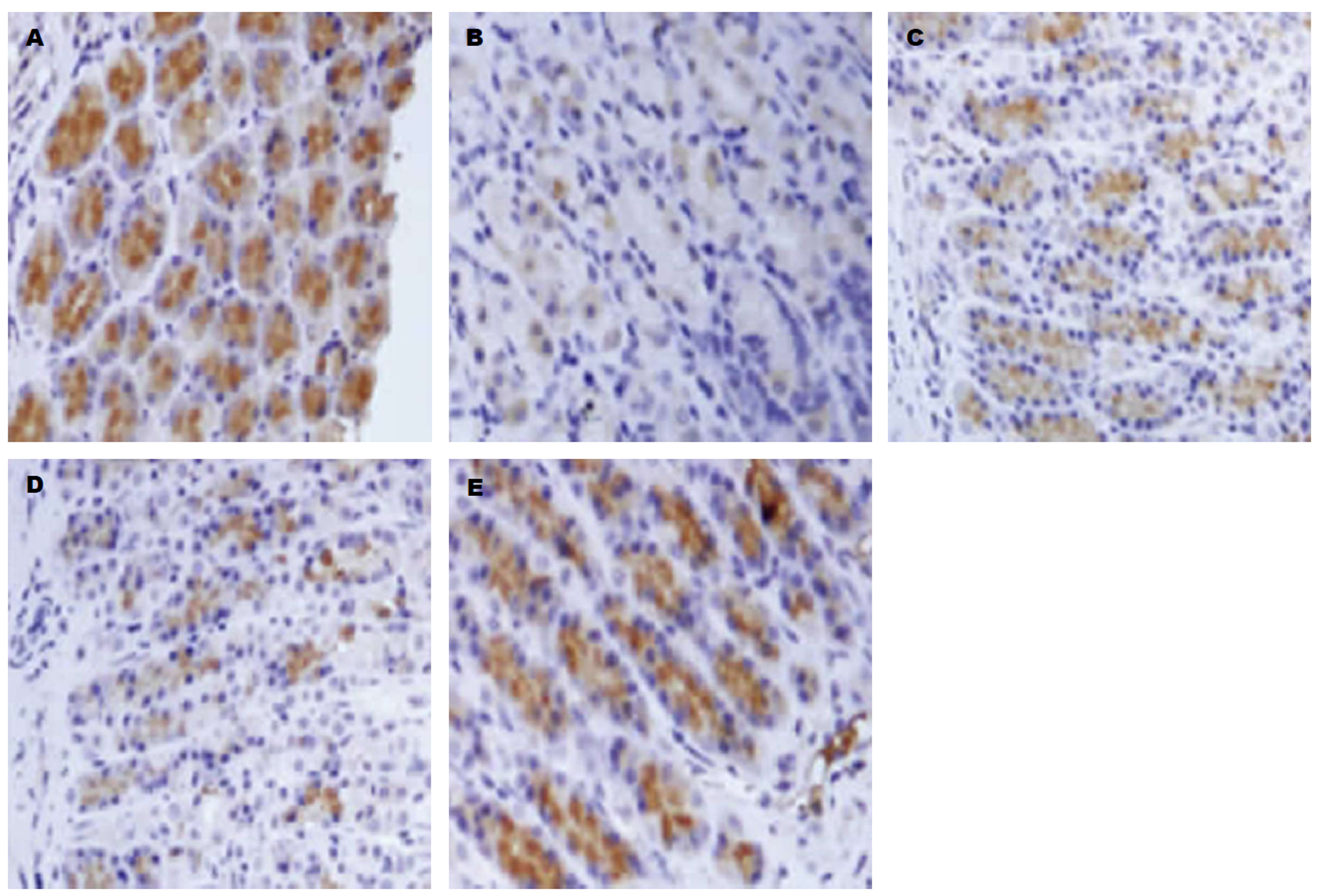
在光镜下免疫组化染色的c-kit阳性的ICC细胞核与细胞质为棕黄色颗粒(图中箭头所示), 在胃窦黏膜肌层肌间的神经丛内分布, 其中正常组着色较深, 颜色明显, c-kit高表达, 模型组阳性细胞分布少, c-kit表达变弱, 阳性对照组、黄芪建中汤加味低剂量组及黄芪建中汤加味高剂量组内可看到c-kit阳性细胞着色较深, 详见图1.
和正常组相比, 模型组大鼠c-kit阳性ICC含量下降; 和模型组相比, 阳性对照组、黄芪建中汤加味低剂量组及黄芪建中汤加味高剂量组大鼠c-kit阳性ICC含量上升, 差异有统计学意义(P<0.05); 和阳性对照组相比, 黄芪建中汤加味低剂量组及黄芪建中汤加味高剂量组大鼠c-kit阳性ICC含量上升, 但差异无统计学意义(P>0.05), 详见表3.
中医学古籍中虽然没有关于DGP专名, 但依据其临床表征可归于"呕吐"、"胃痛"等范畴内, 以消渴病为基础疾病脾胃病证, 由于消渴病耗气伤阴, 燥热灼津, 再加上降糖类西药对脾胃功能的损伤, 造成患者胃阴亏乏, 机体脾胃失去濡养, 则运化失司, 胃需则无法受盛水谷, 脾虚则无法化生精微, 在胃内停积, 机体气机升降失常, 中焦内气滞, 进而发生湿阻、食滞、痰浊等病理影响. 针对其病机本研究对DGP大鼠采用黄芪建中汤加减, 黄芪建中汤源自《金匮要略》, 方中黄芪拖毒生肌、利尿消肿、益卫固表, 为方中君药; 党参生津、补血、补脾肺气, 桂枝温助阳气、温通经脉、发汗解表, 为方中臣药; 白芍平抑肝阳、柔肝止痛、养血敛阴, 大枣养血安神、补气健脾, 干姜温肺化饮、回阳通脉, 枳壳宽中除胀、行气宽胸, 白术止汗、利尿、补气健脾, 茯苓宁心安神、渗湿利水, 炒麦芽健脾开胃, 行气消食, 为方中佐药; 炙甘草为使, 益脾气、补心气, 调和上述诸药, 全方配伍共起健脾温中益气功效.
ICC为在肠胃道内分布间质细胞, 为胃肠道慢波起搏细胞, 参加到胃肠神经递质的信号传递与基本电节律调控[5,6], 相关研究显示, 在机体胃肠道电与动力出现、运动障碍的机制内ICC有重要影响[7]. 当前多数学者认为临床多种胃肠动力障碍性疾病其关键病理学因素和ICC网络缺失、发育分化障碍及分布或者结构异常有紧密联系, 这也是目前临床对DGP治疗的研究方向之一[8-10]. SCF为具有多种功能的细胞因子, 由于其mRNA酶切和拼接方式不同而形成了mSCF与sSCF两种形式, 它们都有生物活性. c-kit为有酪氨酸激酶活性跨膜蛋白, SCF可经过结合特定受体c-kit而产生配基受体二聚体复合物, 使对应信号转导路径开启, 对细胞不同生物学行为进行调控, 发挥影响[11-13]. c-kit受体和SCF所产生SCF-Kit信号路径, 对于胃肠道内ICC生长、发育、分化及表型的保持有重要作用, 对其结构与数量完整有影响[14]. 龙庆林等[15]人研究显示, DM大鼠的胃排空会显著延迟, 胃窦组织内ICC数量降低, 超微机构受损, 其他细胞和ICC之间缝隙连接松散、结构损坏, 而进一步探究显示DM大鼠胃窦平滑肌组织内c-kit蛋白和SCF mRNA表达量较正常大鼠下降, 说明SCF-Kit信号路径和DM大鼠的ICC变性、网络结构被损和数量下降有联系, 造成其胃运动障碍. 本文研究显示, 和正常组相比, 模型组大鼠c-kit阳性ICC含量下降; 和模型组相比, 黄芪建中汤加味低剂量组及黄芪建中汤加味高剂量组大鼠c-kit阳性ICC含量上升; 和正常组相比, 模型组大鼠胃窦组织内c-kit、mSCF蛋白表达下降; 和模型组相比, 黄芪建中汤加味低剂量组及黄芪建中汤加味高剂量组大鼠c-kit、mSCF蛋白表达上升, 差异有统计学意义, 说明黄芪建中汤可使SCF-Kit信号路径上调, 保持ICC功能, 从而对DGP起到治疗作用.
总之, 黄芪建中汤加味经过提升mSCF蛋白表达, 上调SCF-Kit信号途径, 使DGP大鼠胃窦组织内ICC含量增大, 改善其胃起搏功能, 胃动力增强.
近些年来, 糖尿病胃轻瘫患者发病率逐年升高, 近半糖尿病患者有胃动力障碍紊乱表征. 胃动力障碍不但会导致患者出现一系列胃肠不适症状, 还会影响到血糖控制, 改变口服药物吸收.
西医对于糖尿病胃轻瘫(diabetic gastroparesis, DGP)治疗主要为胃电起博治疗、促进胃动力和控制血糖等, 存在疗效不持久、有一定副作用等问题. 中医采用辨证治疗, 在预防复发、改善症状等方面疗效确切, 有一定优势.
分析黄芪建中汤加味对DGP胃动力指标、胃排空率等疗效影响和对胃窦干细胞因子(stem cell factor, SCF)-Kit信号途径的影响.
制备DGP大鼠模型, 灌胃黄芪建中汤加味, 观察大鼠血糖、可溶型SCF(soluble SCF, sSCF)、胃泌素(gastrin, GAS)、胃动素(motilin, MLT)含量及胃排空率, 胃窦组织内c-kit阳性Cajal间质细胞(interstitial cells of Cajal, ICC)含量和胃窦组织内c-kit、mSCF蛋白表达状况.
模型组相比, 黄芪建中汤加味低剂量组及黄芪建中汤加味高剂量组大鼠血糖、GAS及MLT含量下降, sSCF含量、胃排空率上升, 差异有统计学意义; 和模型组相比, 黄芪建中汤加味低剂量组及黄芪建中汤加味高剂量组大鼠c-kit、mSCF蛋白表达上升, 差异有统计学意义.
黄芪建中汤加味可使DGP大鼠胃窦组织内mSCF蛋白表达量提升, 上调SCF-Kit信号途径, 提高胃窦组织内ICC含量, 增强其胃动力.
由于时间和人力等条件限制, 本研究部分数据难免存在纰漏, 今后还需进一步学习相关的理论知识, 进行临床研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
编辑:崔丽君 电编:张砚梁
| 2. | Zhang CC, Lin YP, Peng Y, Yue ZH, Chen HJ, Yang JW, Liu WW, Liu L. Effects of Electroacupuncture on Ultrastructure of Interstitial Cells of Cajal and Stem Cell Factor-kit Signal Pathway of Gastric Antrum in Diabetic Gastroparesis Rats. Zhen Ci Yan Jiu. 2017;42:482-488. [PubMed] [DOI] |
| 3. | Li H, Chen Y, Liu S, Hou XH. Long-pulse gastric electrical stimulation protects interstitial cells of Cajal in diabetic rats via IGF-1 signaling pathway. World J Gastroenterol. 2016;22:5353-5363. [PubMed] [DOI] |
| 6. | Ward SM. Hyperplasia of Interstitial Cells of Cajal Leads to Rapid Gastric Emptying in Diabetes. Gastroenterology. 2017;153:350-352. [PubMed] [DOI] |
| 7. | 黄 伟. 大黄素致小鼠泻剂结肠形成过程中Cajal间质细胞及SCF/c-Kit的动态变化. 中国普外基础与临床杂志. 2016;23:406-410. [DOI] |
| 9. | Bharucha AE, Daley SL, Low PA, Gibbons SJ, Choi KM, Camilleri M, Saw JJ, Farrugia G, Zinsmeister AR. Effects of hemin on heme oxygenase-1, gastric emptying, and symptoms in diabetic gastroparesis. Neurogastroenterol Motil. 2016;28:1731-1740. [PubMed] [DOI] |
| 10. | Cipriani G, Gibbons SJ, Verhulst PJ, Choi KM, Eisenman ST, Hein SS, Ordog T, Linden DR, Szurszewski JH, Farrugia G. Diabetic Csf1 mice lacking macrophages are protected against the development of delayed gastric emptying. Cell Mol Gastroenterol Hepatol. 2016;2:40-47. [PubMed] [DOI] |
| 11. | Yang S, Wu B, Sun H, Sun T, Han K, Li D, Ji F, Zhang G, Zhou D. Impaired insulin/IGF-1 is responsible for diabetic gastroparesis by damaging myenteric cholinergic neurones and interstitial cells of Cajal. Biosci Rep. 2017;37. [PubMed] [DOI] |
| 12. | Lin G, Zhang J, Li L, Zou Z, Chen C, Xue L, Zhao L. Effect of electroacupuncture on gastric interstitial cells of Cajal in a rat model of diabetic gastroparesis. Exp Ther Med. 2016;11:2489-2494. [PubMed] [DOI] |
| 13. | Choi KM, Gibbons SJ, Sha L, Beyder A, Verhulst PJ, Cipriani G, Phillips JE, Bauer AJ, Ordog T, Camp JJ, Ge X, Bharucha AE, Linden DR, Szurszewski JH, Kashyap PC, Farrugia G. Interleukin 10 Restores Gastric Emptying, Electrical Activity, and Interstitial Cells of Cajal Networks in Diabetic Mice. Cell Mol Gastroenterol Hepatol. 2016;2:454-467. [PubMed] [DOI] |
| 14. | Zhang CM, Huang X, Lu HL, Meng XM, Liu DH, Kim YC, Xu WX. Up-regulation of the Ang II/AT1 receptor may compensate for the loss of gastric antrum ICC via the PI3k/Akt signaling pathway in STZ-induced diabetic mice. Mol Cell Endocrinol. 2016;423:77-86. [PubMed] [DOI] |